Фазы клинических исследований препаратов от рака, депрессии, деменции, гепатита
Когчагина Наталья Юрьевна • 19 мая 2023: Очень часто в новостях появляются сообщения в стиле «ученые нашли средство от рака/депрессии/деменции/гепатита/вирусов и т.п. Что же не так в подобных новостях? Много чего не так, но самое главное – авторы будто не в курсе старой поговорки – «поспешишь – людей насмешишь».
При ближайшем рассмотрении новости и изучения первоисточника часто можно обнаружить, что эти ученые пока что только нашли вещества, которые «способны убивать раковые клетки» или «способны убивать бактерии» или «способны снижать уровень какого-то вещества» в пробирке или у лабораторных животных. Это не значит, что эти вещества покажут эффективность на людях, и будут эффективны в клинических условиях. И прежде чем говорить про биодобавки, посмотрим, как же разрабатываются лекарственные препараты, какой путь они проходят от лаборатории до аптеки.
Первоначальный этап разработки лекарственных препаратов
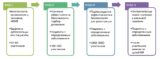
Сначала потенциальное лекарство должно быть найдено в природе или синтезировано. Изучаются его свойства в пробирке, например, на культуре клеток. Затем проводятся исследования на лабораторных животных. Это первоначальный этап разработки лекарственных препаратов. На этом этапе происходит сбор сведений о том, каким образом действует лекарственный препарат, насколько он эффективен и какие токсические эффекты он вызывает, в том числе возможные эффекты в отношении репродуктивной способности и здоровья потомства. На этой стадии многие лекарственные препараты отбраковываются, поскольку они оказываются неэффективными или слишком токсичными. Если на этом этапе все хорошо, дальше подается заявка на проведение клинических исследований на людях. Такие клинические исследования состоят из нескольких фаз; к участию в них привлекаются исключительно добровольцы, давшие свое письменное согласие. Например, для одобрения необходимы три фазы клинических исследований:
В ходе фазы 1 проводится оценка безопасности и токсичности препарата у человека. Небольшому количеству здоровых молодых добровольцев (от 20 до 80 человек) дают препарат в различных дозах, чтобы определить, при какой дозе появляются первые признаки токсичности.
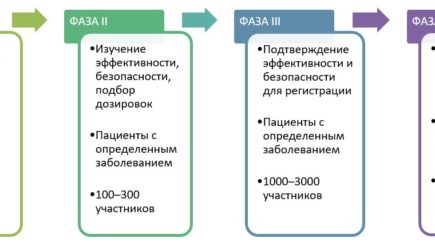
В ходе фазы 2 проводится оценка воздействия, которое оказывает данный препарат на то заболевание/расстройство, против которого он направлен, и определяется надлежащая его доза. В исследовании участвуют до 100 человек, страдающих определенным заболеванием или расстройством, которые получают различные дозы препарата, чтобы выяснить, дает ли это какую-либо пользу. Перспективный механизм действия и положительные результаты на стадии животных еще не означает, что препарат будет воспроизводить такое же действие на людях.
В ходе фазы 3 проводятся испытания препарата на значительно большей (от сотен до тысяч людей) популяции лиц, страдающих определенного рода заболеванием/расстройством. Подбор этих участников производится таким образом, чтобы они были как можно более схожи с людьми, которые могут применять данный препарат в реальности. В ходе дальнейшего изучения эффективности препарата отмечаются новые присущие ему побочные эффекты. В ходе исследований фазы 3 обычно проводится сравнение нового лекарственного препарата с известным проверенным препаратом, с плацебо или же и с тем, и с другим. Кроме определения эффективности лекарственного препарата, исследования на людях сосредоточены на видах и частоте возникновения побочных эффектов и на факторах, которые обуславливают склонность пациентов к возникновению такого рода эффектов (например, возраст, пол, наличие сопутствующих расстройств и применение других лекарственных препаратов).
Если в ходе исследования было установлено, что данный лекарственный препарат достаточно эффективен и безопасен, подается заявка на регистрацию нового лекарственного препарата. FDA изучает представленную информацию и принимает решение о том, достаточно ли препарат эффективен и безопасен, чтобы разрешить его реализацию на фармацевтическом рынке. После утверждения FDA данный лекарственный препарат становится доступным для применения.
Открытие и разработка лекарств — это длительный, дорогостоящий и сопряженный с высоким риском процесс, который занимает более 10-15 лет при средней стоимости более 1-2 миллиардов на каждый новый препарат, одобренный для клинического использования. Для любой фармацевтической компании или учреждения большим достижением является продвижение препарата-кандидата к первой фазе клинических испытаний после тщательной оптимизации препарата-кандидата на доклинической стадии. Однако девять из десяти кандидатов на лекарство после того, как они вступили в клинические исследования, терпят неудачу на этапах I, II, III клинических испытаний и утверждения лекарственного средства.
По другим данным, в среднем из 4000 лекарственных препаратов, которые изучаются в лабораториях, только около 5 изучаются на людях, и только 1 из этих 5 препаратов проходит утверждение и начинает применяться в медицинской практике. Далеко не все клинические исследования дают желаемый результат.
Согласно одному статистическому исследованию, опубликованному в 2021 году, вероятность успешного завершения КИ I фазы составляет около 50 %, II фазы – 30 %, III фазы – 60 %. С учетом этих вероятностей шанс успешного завершения всех трех фаз КИ составляет лишь 10 %. Это означает, что лишь один из десяти экспериментальных препаратов будет зарегистрирован. При этом наименьший шанс на успех имеют препараты для лечения онкологических заболеваний – всего 5 %.
С началом продаж препарата начинается 4 стадия – после-регистрационные или пост маркетинговые исследования. Их задача — выявить те проблемы, которые отсутствовали в ходе фаз 1, 2 или 3, в том числе те, для возникновения которых требуется длительное время и наблюдающиеся редко.
Иногда, как в случае с силденафилом, препарат, который разрабатывали и начинали исследовать для применения при одном состоянии, в ходе исследований показал неожиданный результат, который выявил потенциал для его использования при других состояниях.
Многие препараты не проходят все фазы клинических исследований.
Основные причины досрочного прекращения исследований – отсутствие эффективности или выявление неблагоприятных реакций. В 2016 г была опубликована статья, в которой анализировали неудачные исследования, используя данные в общедоступных базах данных. Изучали данные об исследовании лекарственных препаратов, которые проходили исследования в период с 1998 по 2008 г. Выяснилось, что 54 % исследуемых препаратов потерпели неудачу, из них 57 % — не показали остаточной эффективности, а 17 % оказались недостаточно безопасными.
Ряд методов лечения, которые продемонстрировали многообещающие результаты во время исследований на животных и в ранних стадиях исследований на людях, не показали пользы или повысили риск серьезных побочных осложнений при проведении более крупных исследований. Например, на 640 исследований, негативные отзывы распределись так:
- 10 агентов из-за повышенного риска летального исхода
- 18 – в связи с серьезными побочными эффектами (рак, инсульт, сепсис)
- 5 в связи с отклонениями в лабораторных тестах
- 5 в связи с канцерогенностью или другими серьезными побочными эффектами в ходе долгосрочных клинических исследований
- 21 в связи с нераскрытыми проблемами безопасности или требованиями проведения дальнейших испытаний на безопасности.
Вот примеры, которые я нашла:
Элескломол в комбинации с паклитакселом показал хорошие результаты в отношении повышения выживаемости без прогрессии у пациентов с метастатической меланомой по сравнению с монотерапией паклитакселом во второй фазе. В более крупном исследовании третьей фазы эта комбинация не приводила к значительному повышению выживаемости, и исследование было остановлено, когда в группе комбинированной терапии наблюдалась большая частота летальных исходов.
Тарцетрапиб – ингибитор бека-переносчика эфиров холестерина. Предполагалось, что в комбинации с аторвастатином будет снижать риск сердечно-сосудистых осложнений. При проведении РКИ с участием 15067 пациентов с высоким сердечно сосудистым риском. Пациенты, поучавшие комбинированную терапию наблюдался спустя 12 месяцев более высокий риск сердечно-сосудистых осложнений и смерти от любых причин по сравнению с моно терапией аторвастатином.
Битопертин – повышает доступность глицина в синапсе. Во второй фазе с участием 320 пациентов выявили статистически значимое улучшение в отношении негативных симптомов шизофрении. В трех последующих исследованиях с общим числом участников 1800 пациентов в течение года и более не выявили статистически-значимой разницы в сравнении с плацебо.
Дексмекамиламин, который может нормализовать активность никотиновых рецепторов, потенциально рассматривали как средство для лечения депрессии. В 2009 году в исследовании 2-й фазы были рандомизированы 270 участников для приема либо дексмекамиламина, либо плацебо в течение восьми недель. Исследование показало, что у тех, кто принимал дексмекамиламин, показатели по стандартной шкале депрессии улучшились в большей степени по сравнению с плацебо. С этими многообещающими результатами 2-й фазы дексмекамиламин прошел четыре исследования 3-й фазы. В них в общей сложности было 614 участников исследования, состояние которых не улучшилась при стандартной терапии СИОЗС или ИОЗСН. Их разделили для получения дексмекамиламина или плацебо при продолжении терапии СИОЗС или ИОЗСН. После восьми недель дополнительного лечения эти исследования не выявили различий между лечебными эффектами дексмекамиламина и плацебо при лечении депрессии по стандартным шкалам депрессии ни в одном из исследований фазы 3.
Семагацестат блокирует гамма-секретазу, фермент, участвующий в образовании бета-амилоида, и, таким образом, предназначен для предотвращения накопления бета-амилоида в головном мозге; предполагали, что семагацестат снизит концентрацию бета-амилоидного белка в крови. Исследование 2-й фазы, в котором изучалось влияние семагацестата при болезни Альцгеймера, действительно показало снижение уровня бета-амилоида в крови у пациентов, получавших препарат ежедневно в течение 14 недель. Исследователи надеялись, что влияние семагацестата на уровни бета-амилоида в крови привело бы к клинически значимому улучшению течения заболевания. В исследовании 3-й фазы было рандомизировано более 1500 пациентов, которые получали плацебо или семагацестат в течение 18 месяцев. Исследование было прекращено до его завершения, поскольку у пациентов, принимавших семагацестат, наблюдалось ухудшение когнитивных функций и общего функционирования в период исследования по сравнению с теми, кто принимал плацебо. У пациентов, принимавших семагацестат, было больше побочных эффектов, включая инфекции и онкологические заболевания, по сравнению с плацебо. Фактически, у пациентов, получавших семагацестат, риск развития онкологии кожи был по меньшей мере в два раза выше по сравнению с пациентами, получавшими плацебо.
В законе РФ об обращении лекарственных средств указано, что для регистрации препарата необходимо предоставить результаты клинических исследований, основные цели которых соответствуют целям 1-4 фаз исследований, о которых говорилось выше. Но при этом требования к качеству исследований гораздо мягче.
Показательный пример: регистрационное многоцентровое клиническое исследование по оценке безопасности и терапевтической эффективности препарата афобазола, которое считается исследованием третьей фазы. Но в нем приняли участие только сотни человек. Именно поэтому врачи, придерживающиеся принципамдоказательной медицины называют многие лекарственные разработки «препаратами с недоказанной эффективностью».
То же относится и к биодобавкам. Компоненты БАД подобного пути не проходят. Да, если поискать, можно найти данные об исследованиях разных биодобавок, но все они ограничены малой выборкой и по своей сути являются исследованиями второй фазы.